622ª Reunião DICOL – ANS
Análise da 622ª Reunião Ordinária da Diretoria Colegiada
O M3BS, comprometido em promover o acesso ao conhecimento regulatório, realiza o acompanhamento contínuo das reuniões técnicas da Agência Nacional de Saúde Suplementar (ANS). Esses encontros são fundamentais para identificar diretrizes e tendências que, muitas vezes, extrapolam o conteúdo dos normativos vigentes, permitindo a antecipação de riscos e oportunidades no mercado de saúde suplementar.
Nesse contexto, apresentamos a seguir a análise do M3BS sobre a 622ª Reunião da Diretoria Colegiada (DICOL), realizada em 12 de maio de 2025:
I – ITEM DIPRO – APRECIAÇÃO da proposta de alteração da Instrução Normativa nº 53, da Diretoria de Normas e Habilitação dos Produtos, de 18 de julho de 2017; e APROVAÇÃO (i) da análise da Avaliação de Resultado Regulatório referente ao normativo que regulamenta a visita técnico-assistencial, consubstanciado na Nota Técnica nº 41/2023/GEDIT/GGRAS/DIRAD-DIPRO/DIPRO e na Nota Técnica nº 18/2024/GEDIT/GGRAS/DIRAD-DIPRO/DIPRO; (ii) da autorização para a realização de Consulta Pública pelo período de 45 dias, nos termos do art. 9º da Lei nº 13.848, de 2019, do Decreto nº 10.411, de 2020 e da RN nº 548, de 2022. Processo: 33910.011545/2023-32.
Trata-se do processo de ARR – Avaliação de Resultado Regulatório, referente à Visita Técnico-Assistencial, regulamentada pela Instrução Normativa nº 53, de 18 de julho de 2017, da Diretoria de Normas e Habilitação dos Produtos – DIPRO, que regulamenta a visita técnico-assistencial para identificação de anormalidades assistenciais nas operadoras de planos de assistência à saúde.
A ARR consiste na verificação dos efeitos decorrentes da edição de ato normativo, considerando o alcance dos objetivos originalmente pretendidos e os demais impactos observados sobre o mercado e a sociedade, em decorrência de sua implementação. O intuito é avaliar se o instrumento regulatório permanece adequado e se há necessidade de revisão.
A metodologia aplicada envolve os seguintes critérios:
– Qualificação: A equipe foi capacitada para a participação.
– Histórico: Foi analisado o histórico das visitas técnicas na DIPRO, desde 2011.
– Análise documental: Foram analisados todos os processos referentes às visitas já realizadas.
– Entrevistas: para melhor compreensão do contexto, foram realizadas entrevistas com as gestoras responsáveis pelas visitas.
Razões de crítica:
- Verificou-se a necessidade da elaboração do novo normativo, em razão da ineficiência do processo de trabalho, diante da contestação da existência de alto custo de execução, em função de diárias e passagens dos servidores.
- Envolvimento de servidores de várias gerências, com menor disponibilidade para a análise dos dados das visitas, tornando o processo moroso, com comprometimento dos resultados esperados.
- Metodologia do cálculo do risco assistencial utilizada, em grande medida, para identificação e priorização das operadoras que seriam objeto de visitas técnico-assistenciais.
- Auditoria do TCU que recomendou necessidade de melhor definição das competências da DIPRO e da DIFIS, para não haver sobreposição de competências das diretorias. Processo de análise do Tribunal de Contas da União (Processo no. TC 023.176/2015-6) e posterior Acórdão 79/2017, que indicou a necessidade de definição das competências da Diretoria de Normas e Habilitação de Produtos e da Diretoria de Fiscalização da ANS “em matéria de visita técnico assistencial e de fiscalização, de forma a não haver sobreposição ou lacunas na execução das atividades de monitoramento e de fiscalização entre as duas diretorias”, preferencialmente por uma atuação integrada e sem sobreposição entre as Diretorias.
Objetivos da publicação da IN nº 53/2017
Objetivo Geral:
- Aprimoramento da regulamentação das visitas técnico-assistenciais, tornando-as eficientes como instrumento de monitoramento, regulamentando o disposto na RN 416/16.
Objetivos específicos:
- Conceituar e delimitar o escopo das visitas técnico-assistenciais.
- Estabelecer a forma de programação através do Plano Periódico de Monitoramento Assistencial, estabelecer a elegibilidade das operadoras para receberem as visitas.
- Definir a coordenação das visitas.
- Estabelecer a forma de registro das visitas através de Nota Técnica.
- Distinguir o instrumento da visita técnico-assistencial e as atividades fiscalizatórias, de forma a evitar sobreposições de ações na atuação da DIPRO e da DIFIS.
Restou salientado que, em 2022, a IN nº 53 / DIPRO foi alterada pela IN nº 59 / DIPRO, sobretudo quanto à coordenação das visitas, cuja competência passou da gerência de monitoramento assistencial para a gerência de direção técnica.
Foi destacado que todos os objetivos foram cumpridos. Contudo, indicou-se haver ações normativas que podem aprimorar a norma.
A gerência acredita que as alterações propostas dispensam a necessidade de Análise de Impacto Regulatório fundamentada pelos incisos III, IV e VII, do artigo 4º do Decreto nº 10.411/2020, quais sejam:
(…)
III – ato normativo considerado de baixo impacto;
IV – ato normativo que vise à atualização ou à revogação de normas consideradas obsoletas, sem alteração de mérito;
(…)
VII – ato normativo que reduza exigências, obrigações, restrições, requerimentos ou especificações com o objetivo de diminuir os custos regulatórios;
(…)
Foi reforçado que as alterações propostas não trazem novas obrigações dos entes regulados, apenas visam aprimoramento do processo de trabalho da visita técnica.
A alterações propostas são:
- Atualização e adequação da redação.
- Inclusão de prazo mínimo para comunicar a operadora sobre a visita técnico-assistencial.
- Previsão de autuação no caso de descumprimento na entrega da documentação requisitada.
- Mudança de Instrução Normativa para Resolução Normativa, pois o normativo não fará menção e não disciplinará outra norma.
- Alteração do fluxo processual, a proposta é de simplificação das etapas do processo, sem prejuízo da oportunidade de manifestação dos entes regulados.
A seguir, segue a ilustração da alteração do fluxo proposto:
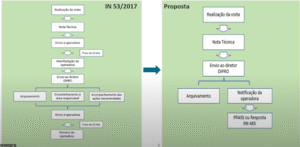
É importante salientar que a realização da visita técnica era de atribuição da gerência de monitoramento assistencial e os desdobramentos para tomada de medidas administrativas era de atribuição da gerência de direção técnica.
Com base na figura acima, o novo fluxo proposto exclui as fases de ciência da operadora, tanto em relação ao teor da nota técnica para posterior aprovação do diretor da DIPRO, quanto a nota técnica com as recomendações (de arquivamento / encaminhamento à área responsável / acompanhamento das ações recomendadas). Ou seja, foram suprimidas as oportunidades de apresentação de recurso pela operadora.
Assim, no novo fluxo proposto, a nota técnica vai indicar arquivamento ou necessidade de notificação da operadora quanto aos indícios de anormalidades administrativas assistenciais. Portanto, se foram identificados, durante a visita, indícios de anormalidades assistenciais, a operadora será notificada, nos termos do artigo 3º da RN 485, podendo apresentar PRASS (Plano de Recuperação Assistencial) ou comprovação da resolução ou ausência das anormalidades listadas na nota técnica.
O item foi aprovado por unanimidade.
II – ITEM EXTRAPAUTA DIFIS – APRECIAÇÃO da alteração da Resolução Normativa nº 623/2024, que dispõe sobre as regras a serem observadas pelas Operadoras de Planos Privados de Assistência à Saúde e Administradoras de Benefícios nas solicitações de procedimentos ou serviços de cobertura assistencial apresentados pelos beneficiários, bem como não assistenciais, em qualquer modalidade de contratação. Processo 33910.014327/2023-50.
A apresentação da Diretoria de Fiscalização foi iniciada com destaque para o fato de que, durante o período de vacância da norma, foi identificada a necessidade de ajustes pontuais. A seguir, seguem as 3 (três) alterações propostas que, de acordo com a DIFIS, representam ajustes pontuais de natureza operacional:
1) Classificação trimestral em metas IGR e respectiva repercussão na atividade fiscalizatória: substituir a expressão “data do fato” por “data do registro da demanda na ANS”.
Tal alteração foi proposta, pois entendeu-se mais adequado trocar o marco da “data do fato” para “data de registro”, pois esse é fato incontroverso.
2) Em razão da proposta anterior, a circunstância agravante prevista não alcançará a conduta apurada por meio do rito da representação.
Tal alteração foi proposta em respeito às áreas técnicas que representam as demais diretorias, pois cada área técnica possui um cronograma de abertura de demanda e poderia ocorrer alguma incoerência com relação ao item 1.
3) Ampliar a clareza do art. 26, § 9º com o acréscimo de expressão que faz referência à unidade competente pela distribuição de relatoria em segunda instância.
Tal alteração foi proposta, pois, por lapso, foi citada apenas relatoria em segunda instância, faltando citar a unidade competente. O referido dispositivo assim dispõe:
“Art. 26. As condições especiais previstas no art. 25 destinam-se exclusivamente às operadoras que estiverem com o IGR menor ou igual à metade do IGR médio do setor de acordo com as seguintes regras.
(…)
- 9º Nos casos do § 5º, II, e quando recebido o requerimento pelo relator de segunda instância, os autos serão remetido para Diretoria de Fiscalização para proferir decisão homologando o desconto, que será objeto de intimação pelo órgão técnico que a proferiu.”
O item foi aprovado por unanimidade.
III – ITEM EXTRAPAUTA DIPRO – APROVAÇÃO da proposta de atualização do Rol de Procedimentos e Eventos em Saúde – Nota Técnica de Recomendação Final referente à UAT 128. Processo nº 33910.011450/2023-19.
Foram propostas atualizações das DUT´s – 65.9 e 65.10 para atualizar a cobertura da “TERAPIA IMUNOBIOLÓGICA ENDOVENOSA, INTRAMUSCULAR OU SUBCUTÂNEA” em relação ao tratamento da ASMA GRAVE:

Para a aprovação, foram realizadas as seguintes reuniões e Consultas Públicas:
- 30ª Reunião Técnica da COSAÚDE, realizada em 26/06/2024, para apresentação da proposta de atualização (demanda interna) das DUTs 65.9 e 65.10, conforme Nota Técnica nº 9/2024/GCITS/GGRAS/DIRAD-DIPRO/DIPRO;
- 32ª Reunião Técnica da COSAÚDE, realizada em 21/08/2024, para discussão da PAR e elaboração de relatório preliminar da comissão;
- Para coleta de contribuições quanto às recomendações preliminares contidas na NTRP nº 35/2024/GCITS/GGRAS/DIRAD-DIPRO/DIPRO, inicialmente, a proposta de atualização das DUTs 65.9 (ASMA EOSINOFÍLICA GRAVE) e 65.10 (ASMA ALÉRGICA GRAVE) foi submetida à Consulta Pública – CP nº 137/2024. Por motivos técnicos, a CP nº 137 foi suspensa em 04/10/2024, tendo sido coletadas 20 contribuições entre 25/09/2024 e 03/10/2024. Após ajustes, a CP nº 148/2025 retomou a coleta de contribuições para proposta de atualização das DUTs 65.9 e 65.10, tendo sido coletadas 160 contribuições entre 22/01/2025 a 10/02/2025. Para fins de elaboração do Relatório de Consolidação da Participação Social Ampliada, as contribuições das CPs nº 137 e 148 foram analisadas em conjunto (total de 180 contribuições)
- 39ª Reunião Técnica da COSAÚDE (após participação social ampliada), realizada nos dias 29 e 30/04/2025, para a apresentação e discussão quanto à análise das contribuições das CPs nº 137/2024 e 148/2025, com elaboração de relatório final da comissão.
As propostas de versão final das DUT´s seguem abaixo, com grifo nas modificações:


Com base no detalhamento, apresentou-se para:
a) apreciação do relatório de consolidação das contribuições da participação social ampliada (Consultas Públicas nº 137/2024 e nº 148/2025);
b) apreciação do relatório final da COSAÚDE para a UAT nº 128; e
c) apreciação e deliberação quanto às recomendações finais desta área técnica para a UAT nº 128.
a) aprovação da minuta de resolução normativa que atualizará o Rol de Procedimentos e Eventos em Saúde, cuja vigência se propõe para 02 de junho de 2025.
O item foi aprovado por unanimidade.
IV – ITEM EXTRAPAUTA DIPRO – APROVAÇÃO da proposta de atualização do Rol de Procedimentos e Eventos em Saúde – Nota Técnica de Recomendação Preliminar referente às UATs 154 e 159. Processo nº 33910.019310/2025-51.
Foi recomendada a inclusão das seguintes Unidades de Análise Técnica (UAT):

ANIFROLUMABE:
A evidência atualmente disponível sobre a eficácia e segurança de anifrolumabe para tratamento de pacientes com lúpus eritematoso sistêmico (LES), com moderada a alta atividade da doença e com falha à terapia tripla, é baseada em três ensaios clínicos randomizados (TULIP-1, TULIP-2 e TULIP-LTE). Os estudos possuem fragilidades significativas quanto à representatividade da população-alvo, pois não incluíram exclusivamente pacientes em terapia tripla.
Os achados foram favoráveis ao anifrolumabe quanto aos desfechos de resposta ao tratamento (BICLA), redução de atividade cutânea (CLASI) e eventos adversos graves (com certeza da evidência baixa), bem como à redução no uso de corticosteroides (com certeza da evidência muito baixa). Não houve diferença significativa nos desfechos LEDAI-2K, que avalia a atividade global da doença, e SRI-4, ferramenta composta que avalia a resposta ao tratamento.
Assim, considerando que a validade externa dos estudos é restrita, aplicável a uma população que não é a proposta, e que a certeza da evidência variou de baixa a muito baixa, cabe cautela na interpretação desses resultados com vistas à aplicação prática no cenário proposto.
Sobre a avaliação econômica, a tecnologia apresentou uma razão de custo-utilidade incremental superior a R$ 271 mil por ano de vida ajustado pela qualidade (AVAQ) ganho em comparação à terapia tripla (tratamento padrão). Ademais, estimou-se um impacto incremental positivo a partir da inclusão ao rol, com acréscimo de custos superior a R$ 44,2 milhões ao ano no cenário de difusão mais provável – de 40% no ano 1 a 80% no ano 5, para uma população estimada em 1.987 pacientes ao ano.
SELPERCATINIBE:
As evidências atualmente disponíveis sobre a eficácia e segurança de selpercatinibe para o tratamento do câncer medular de tireoide (CMT) avançado ou metastático com mutação no gene RET são oriundas de três estudos: (i) um ECR fase III (LIBRETTO-531), que o comparou com cabozantinibe ou vandetanibe, e (ii) dois estudos de braço único (LIBRETTO-001 e LIBRETTO-321), todos com alto risco de viés. Note-se que vandetanibe não está disponível no Rol e que cabozantinibe não tem registro no Brasil para a indicação proposta. Não foram encontrados ensaios clínicos que compararam selpercatinibe com quimioterapia disponível na saúde suplementar.
Os achados do ensaio clínico de fase III (LIBRETTO-531) indicam que selpercatinibe reduz em 63% o risco de morte e em 72% o risco de progressão da doença ou morte, ambos com moderada certeza da evidência. Ademais, selpercatinibe pode aumentar a taxa de resposta completa e pode melhorar a qualidade de vida, com baixa certeza da evidência. Quanto à segurança, parece não haver diferença na incidência de qualquer evento adverso (baixa certeza da evidência) e o seu efeito é incerto no risco de eventos adversos graves (muito baixa certeza da evidência).
É relevante registrar as limitações do estudo LIBRETTO-531, tais como, comparação com medicamentos não contemplados no Rol, dados imaturos de sobrevida global e de sobrevida livre de progressão, ocorrência de crossover com potencial impacto na análise da sobrevida global, e estimativas afetadas por limitações metodológicas (alto risco de viés de performance, mensuração e atrito) e imprecisão dos resultados. Assim, a aplicabilidade da análise na saúde suplementar brasileira é restrita, comprometendo as conclusões sobre a eficácia e a segurança do medicamento.
Sobre a avaliação econômica, o proponente calculou uma razão de custo-utilidade incremental de aproximadamente R$ 804 mil por ano de vida ajustado pela qualidade (AVAQ) ganho em comparação à quimioterapia citotóxica. A análise do impacto orçamentário efetuada pelos pareceristas estimou gasto incremental médio de R$ 23,2 milhões por ano em caso de incorporação de selpercatinibe, considerando uma população elegível de 31 pacientes em média por ano.
Com base no detalhamento das motivações, é apresentada a NTRP nº 17/2025/GCITS/GGRAS/DIRAD-DIPRO/DIPRO à Diretoria Colegiada da ANS para:
a) apreciação dos relatórios preliminares da COSAÚDE para as UATs nº 154 e nº 159;
b) apreciação das recomendações preliminares desta área técnica, referentes às UATs nº 154 e nº 159;
c) aprovação da realização de consulta pública, pelo prazo de 20 (vinte) dias, no período de 15/05/2025 a 03/06/2025, com base no inciso III, §11, do art. 10, da Lei nº 9.656/1998 e no art. 26, da RN nº 555/2022, suprimindo-se o prazo previsto no § 2º, do art. 22º, da RN nº 548/2022.
d) aprovação da realização de audiência pública, nos termos do previsto no inciso IV, § 11, do art. 10 da Lei nº 9.656/1998 e no art. 27, da RN nº 555/2022, no dia 21/05/2025, tendo em vista as recomendações preliminares desfavoráveis apresentadas para as UATs nº 154 e nº 159.
O item foi aprovado por unanimidade.
O M3BS faz o acompanhamento de todas as reuniões da Diretoria Colegiada da ANS para atualizar e manter o mercado informado sobre os principais pontos debatidos pela agência reguladora, além de orientar e antecipar os efeitos aplicáveis aos entes regulados frente às decisões tomadas pela agência.
Nosso time de especialistas pode atender sua necessidade! Contate-nos através do e-mail m3bsresponde@m3bs.com.br ou por telefone (11) 3115-2282.
Notícias Relacionadas
Mais Informações
MBS3 © Todos os direitos reservados.



