629ª Reunião DICOL – ANS
Análise da 629ª Reunião Ordinária da Diretoria Colegiada
O M3BS, com o compromisso de levar conhecimento regulatório aos seus clientes faz acompanhamento de todas as reuniões técnicas da Agência Nacional de Saúde Suplementar (ANS), considerando que é por meio desses encontros que a reguladora especifica pontos importantes a serem trabalhados no setor, os quais vão muito além daqueles já previstos nos normativos vigentes e podem contribuir com a antecipação dos riscos e vantagens do mercado.
Desta forma, sobre a 629ª Reunião da DICOL realizada em 06 de outubro de 2025, o M3BS pontua sua análise, contendo, a seguir: (i) sumário executivo e (ii) descrição aprofundada dos itens de pauta:
SUMÁRIO EXECUTIVO:
- Atualização normativa sobre visita técnico-assistencial (IN nº 53/2017): aprovação, por unanimidade, da proposta de nova norma que substituirá a atual IN, incorporando contribuições da Consulta Pública nº 156/2025. As principais mudanças incluem adequação de redação, ampliação do prazo de comunicação prévia da visita de 10 para 15 dias e fixação de 10 dias para resposta às solicitações feitas durante a inspeção.
- Ativos garantidores (RN nº 521/2022): deliberação favorável à abertura de processo de alteração normativa, com aprovação da realização de Participação Social Dirigida como etapa preliminar, a ser seguida por Consulta Pública de 45 dias, visando ajustes na regulação sobre custódia, movimentação e limites de alocação de ativos garantidores.
- Atualização do Rol – tecnologias recomendadas pela CONITEC: aprovação da inclusão obrigatória no Rol de tecnologias cuja incorporação ao SUS foi publicada entre 15/07/2025 e 16/09/2025. Deliberou-se pela alteração da DUT nº 119, referente à Elastografia Hepática Ultrassônica, para ampliar as indicações de cobertura obrigatória (Hepatite B e C, HIV, esquistossomose, doença hepática gordurosa não alcoólica).
- Atualização do Rol – UAT nº 170 (Radioterapia IMRT para tumores de reto): aprovação, por unanimidade, da Nota Técnica de Recomendação Final, após análise técnica, participação social e relatório da COSAÚDE, consolidando a incorporação do procedimento ao Rol de Procedimentos e Eventos em Saúde.
- Atualização do Rol – UATs nº 167 e 172 (imunobiológicos Guselkumabe e Risanquizumabe): aprovação da Nota Técnica de Recomendação Preliminar, com parecer favorável à incorporação do Guselkumabe e desfavorável ao Risanquizumabe. Foi deliberada a abertura de Consulta Pública de 20 dias (09/10/2025 a 28/10/2025) para receber contribuições específicas sobre o tema.
DESCRIÇÃO DOS ITENS:
I. ITEM DIPRO – APRECIAÇÃO da consolidação e análise das contribuições recebidas durante a Consulta Pública nº 156/2025 e da proposta de norma que substituirá a Instrução Normativa da Diretoria de Normas e Habilitação dos Produtos – IN/DIPRO nº 53/ 2017, que regulamenta a visita técnico-assistencial para identificação de anormalidades assistenciais nas operadoras de planos de assistência à saúde.
O item submetido à apreciação da Agência Nacional de Saúde Suplementar (ANS) refere-se à revisão da Instrução Normativa nº 53/2017 da Diretoria de Normas e Habilitação dos Produtos – DIPRO, que disciplina a realização da visita técnico-assistencial nas operadoras de planos de saúde. Esse instrumento tem como finalidade verificar e identificar eventuais anormalidades assistenciais na prestação de serviços pelas operadoras, funcionando como uma ferramenta de fiscalização preventiva e de indução regulatória.
Após a aprovação da Avaliação de Resultado Regulatório (ARR) e a autorização para abertura de consulta pública, a ANS consolidou as contribuições recebidas no âmbito da Consulta Pública nº 156/2025, que contou com a participação da sociedade civil, do setor regulado e de especialistas técnicos.
Nesse contexto, o presente item consiste na apreciação da análise das manifestações apresentadas na consulta pública e na deliberação sobre a proposta de novo normativo que substituirá a IN nº 53/2017.
Ressalte-se que o objetivo da proposta é atualizar e aprimorar os critérios e procedimentos da visita técnico-assistencial, tornando-os mais adequados ao cenário atual da saúde suplementar, às exigências de transparência regulatória e às práticas de fiscalização baseadas em risco. A apreciação pela Diretoria Colegiada da ANS, portanto, busca validar tanto o processo de participação social quanto os ajustes técnicos sugeridos, definindo os próximos passos para a edição da nova instrução normativa.
A título de conhecimento, vale lembrar que a Consulta Pública nº 156/2025 foi aberta pela ANS em 22 de maio de 2025, permanecendo disponível para recebimento de contribuições até 6 de julho de 2025, dentro do prazo regulamentar de 45 dias estabelecido pela Resolução Normativa nº 548/2022.
Durante esse período, todos os documentos de suporte e informações relacionadas ao processo foram disponibilizados no portal da Agência, garantindo transparência e ampla participação dos interessados no debate sobre a revisão da Instrução Normativa nº 53/2017 (DIPRO).
A ANS informa que o final do processo, a ANS contabilizou 37 contribuições, das quais 3 foram consideradas fora do escopo da consulta. As demais manifestações foram analisadas em conjunto para subsidiar a construção da proposta de novo normativo. Nesse contexto, produziu-se o seguinte resultado:
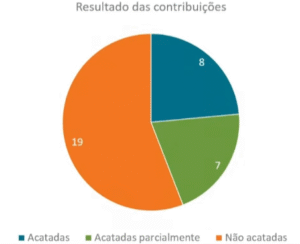
Durante a análise das manifestações apresentadas na Consulta Pública nº 156/2025, algumas contribuições foram acolhidas, total ou parcialmente, ensejando ajustes relevantes na proposta normativa que substituirá a IN/DIPRO nº 53/2017.
Entre as principais alterações está a correção e adequação de redação, medida que busca aprimorar a clareza e a precisão técnica do texto, garantindo maior segurança jurídica e coerência na aplicação da norma.
Além disso, houve a ampliação do prazo para comunicação prévia às operadoras sobre a realização da visita técnico-assistencial, que passou de 10 para 15 dias (artigo 5º), assegurando tempo adicional para a preparação e organização interna das informações necessárias. Também foi incluída a definição de prazo específico de 10 dias para que a operadora apresente as informações requisitadas durante a visita (artigo 5º, § 2º), estabelecendo maior objetividade e previsibilidade no procedimento. Essas mudanças reforçam a busca por equilíbrio entre a efetividade da fiscalização regulatória e a previsibilidade operacional das operadoras de saúde.
O item foi apreciado e a aprovado de forma unanime pela mesa diretora e seguirá para implementação na redação da proposta de normativo e submissão do texto à Procuradoria Federal junto à ANS para análise jurídica e comentários.
Essa etapa demonstra a efetiva abertura da Agência à participação social e ao diálogo regulatório, permitindo que sugestões do mercado, de especialistas e da sociedade civil fossem incorporadas ou avaliadas, de modo a aprimorar o instrumento regulatório que disciplina a visita técnico-assistencial às operadoras de planos de saúde.
O M3BS seguirá acompanhando o tema e as próximas etapas, informando o mercado sua atualização.
II. ITEM DIOPE – APROVAÇÃO (i) da dispensa da Análise de Impacto Regulatório; e (ii) da realização de consulta pública pelo prazo de 45 (quarenta e cinco) dias para propiciar à sociedade civil e aos agentes regulados a possibilidade de apresentar sugestões e contribuições para a proposta de alteração da Resolução Normativa nº 521, de 29 de abril de 2022.
Aberta a discussão do item, foi sugerido pelo Diretor Presidente a conversão de Consulta Pública em Participação Social Dirigida, com o objetivo de propiciar o mais espectro possível do mercado e público afetado ao tema.
A mesa diretora acolheu a sugestão de forma unânime, desde que seja mais uma fase do processo, ou seja, a Participação Social Dirigida, seguida de abertura de Consulta Pública posterior.
Não houve apresentação dos itens que se pretendem alteração/ajuste da norma na presente reunião. Assim, considerando a ANS pretende o ajuste na Resolução Normativa nº 521/22 que trata da aceitação, registro, vinculação, custódia, movimentação e limites de alocação e de concentração na aplicação dos ativos garantidores das operadoras no âmbito do sistema de saúde suplementar, o tema será discutido nos próximos dias com disponibilização dos documentos pertinentes junto ao site da ANS.
Após a avaliação da Participação Social Dirigida, será aberta Consulta Pública para recebimento de contribuições da proposta de norma aplicada.
O M3BS seguirá acompanhando o tema e as próximas etapas, informando o mercado sua atualização.
III. ITEM EXTRAPAUTA DIPRO – DELIBERAÇÃO da proposta de atualização do Rol de Procedimentos e Eventos em Saúde – Tecnologias em saúde recomendadas positivamente pela Comissão Nacional de Incorporação de Tecnologias no Sistema Único de Saúde – CONITEC, para incorporação ao Sistema Único de Saúde – SUS
Trata-se da apresentação das tecnologias em saúde recomendadas positivamente pela CONITEC (Comissão Nacional de Incorporação de Tecnologias no SUS), que tiveram sua decisão de incorporação publicada no Diário Oficial da União (DOU) entre 15/07/2025 e 16/09/2025.
Insta rememorar que o rito de incorporação de tecnologias recomendadas pela CONITEC ao Rol de Procedimentos e Eventos em Saúde Suplementar está disciplinado na RN nº 555/2022, em especial no artigo 33. O dispositivo estabelece que toda tecnologia cuja decisão de incorporação ao SUS tenha sido publicada no Diário Oficial da União deve ser incluída no Rol da saúde suplementar no prazo máximo de 60 dias, garantindo alinhamento regulatório entre os dois sistemas de saúde.
Nesse processo, cabe à DIPRO emitir a Nota Técnica de Tecnologia CONITEC, que deve avaliar: (i) se o procedimento ou medicamento já está previsto no Rol; (ii) se houve efetiva incorporação às coberturas obrigatórias do SUS ou mera ampliação de uso de tecnologia já existente; (iii) se a incorporação ocorreu para indicação diferente da aprovada pela ANVISA, em conformidade com o art. 19-T da Lei nº 8.080/1990 e regulamentações correlatas; e (iv) a compatibilidade da nova incorporação com o ordenamento jurídico da saúde suplementar, especialmente no que se refere aos requisitos do art. 10 da Lei nº 9.656/1998.
Dessa forma, o rito assegura que a transposição das tecnologias aprovadas no SUS para a saúde suplementar ocorra de maneira criteriosa, observando tanto a legislação sanitária quanto a regulação específica do setor.
A DIPRO reforça que a medida cumpre, igualmente, o que dispõe o § 10 do art. 10 da Lei nº 9.656/1998, segundo o qual todas as tecnologias avaliadas e recomendadas positivamente pela CONITEC, cuja decisão de incorporação ao SUS já tenha sido formalmente publicada, devem ser incluídas no Rol no prazo máximo de 60 dias. Refere-se, portanto, a um processo legalmente obrigatório, que visa alinhar a cobertura mínima obrigatória dos planos de saúde às inovações tecnológicas já aprovadas e incorporadas no âmbito do Sistema Único de Saúde.
Nesse contexto, foram publicados 4 Relatórios de Recomendação (RR) com decisão de incorporação ao SUS, a saber: nºs 894/2025, 1010/2025, 1014/2025 e 1026/2025 e 1 RR com decisão de ampliação de uso nº 1029/2025.
Além disso, foram emitidos 10 Relatórios de Recomendação referentes a Protocolos Clínicos e Diretrizes Terapêuticas (PCDT), 1 RR relativo à aprovação de Diretriz Brasileira (CB 977/2025) e 9 RR com decisão de não incorporação ao SUS (nºs 1013/2025, 1015/2025, 992/2025, 1017/2025, 1018/2025, 1028/2025, 1030/2025, 1033/2025 e 1032/2025).
A seguir, passa-se à análise das tecnologias em comento e sua situação pós avaliação da ANS:


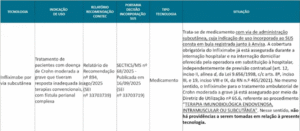
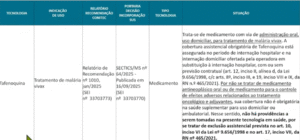
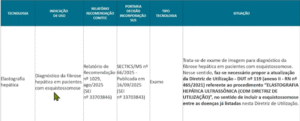
Após a apresentação das situações das análises das tecnologias indicadas para incorporação, foi apresentada Nota Técnica para apreciação, que sugere apenas a modificação da DUT 119, já que os demais procedimentos já possuem similar no anexo II da RN 465/21 e não são aptos à incorporação.
Portanto, a DIPRO propõe a alteração da cobertura assistencial vinculada à Diretriz de Utilização (DUT) nº 119, especificamente no procedimento “Elastografia Hepática Ultrassônica (com Diretriz de Utilização)”.
A alteração sugerida amplia e detalha as condições clínicas em que a cobertura passa a ser obrigatória. Assim, o exame deverá ser garantido a pacientes: com diagnóstico de Hepatite B, Hepatite C, Hepatite C pós-transplante, HIV, esquistossomose ou doença hepática gordurosa não alcoólica, sempre que houver suspeita ou confirmação de fibrose ou cirrose hepática.
O procedimento poderá ser indicado em diferentes estágios do cuidado: diagnóstico inicial, estadiamento da doença e acompanhamento clínico, reforçando o papel da elastografia como ferramenta essencial no monitoramento das condições hepáticas crônicas e na definição de condutas terapêuticas.
Os relatórios e Nota Técnica foram deliberados, sendo aprovada esta última para apenas ajuste na DUT 119, incluindo mais um diagnóstico para cobertura do procedimento. A incorporação será válida a partir de novembro de 2025.
O M3BS recomenda a revisão dos fluxos de auditoria da Operadora para incorporar o novo diagnóstico considerado para cumprimento dos requisitos, evitando assim negativas indevidas
IV. ITEM EXTRAPAUTA DIPRO – DELIBERAÇÃO da proposta de atualização do Rol de Procedimentos e Eventos em Saúde – Nota Técnica de Recomendação Final – NTRF referente à Unidade de Análise Técnica – UAT nº 170
Aberto o item, foi submetida à apreciação da Diretoria Colegiada a Nota Técnica de Recomendação Final – NTRF referente a:
- UAT nº 170 – relativa à radioterapia de intensidade modulada (IMRT), proposta para tratamento de pacientes adultos com tumores do reto.
A título de conhecimento, o histórico da análise da tecnologia em questão demonstra o cumprimento das etapas formais previstas no processo regulatório da ANS para avaliação e eventual incorporação ao Rol de Procedimentos e Eventos em Saúde.
A tramitação iniciou-se com a 42ª Reunião Técnica preliminar da COSAÚDE, realizada em 29 e 30 de julho de 2025, ocasião em que a tecnologia foi apresentada e discutida de forma inicial, resultando na elaboração do relatório preliminar da comissão.
Em seguida, a matéria foi submetida à Consulta Pública nº 160/2025, aberta entre 13 de agosto e 1º de setembro de 2025, com o objetivo de colher contribuições da sociedade quanto à recomendação preliminar constante da NTRP nº 29/2025/GCITS/GGRAS/DIRAD-DIPRO/DIPRO.
Após a participação social, o processo culminou na 44ª Reunião Técnica da COSAÚDE, realizada em 24 de setembro de 2025, quando foram apresentadas e debatidas as contribuições recebidas durante a consulta pública. Nessa fase final, foi elaborado o relatório definitivo da comissão, consolidando a análise técnica e as manifestações da sociedade para subsidiar a decisão da Diretoria Colegiada da ANS sobre a atualização do Rol.
Após todo percurso de análise, a recomendação inicial que era favorável, se manteve pela seguinte motivação:

Após as conclusões, a NTRF nº 42/2025/GCITS/GGRAS/DIRAD-DIPRO/DIPRO, encaminhada à Diretoria Colegiada da ANS, consolidando as etapas finais do processo regulatório referente à UAT 170, sendo apresentados os pontos objeto de deliberação.
O documento contemplou:
- a) a apreciação do relatório de consolidação das contribuições oriundas da participação social ampliada, recebidas na Consulta Pública nº 160/2025, garantindo a análise das manifestações da sociedade civil e do setor regulado;
- b) a apreciação do relatório final da COSAÚDE sobre a UAT 170, consolidando a avaliação técnica da comissão especializada;
- c) a apreciação e deliberação quanto à recomendação final da área técnica, que expressa a posição conclusiva sobre a incorporação ou alteração avaliada; e
- d) a apreciação e deliberação da versão final da minuta de resolução normativa, destinada a atualizar o Rol de Procedimentos e Eventos em Saúde.
Concluindo a apresentação e comentários, o item foi aprovado por unanimidade pela mesa diretoria.
O M3BS recomenda a revisão dos fluxos de auditoria da Operadora para incorporar o novo procedimento, evitando assim negativas indevidas.
V.ITEM EXTRAPAUTA DIPRO – DELIBERAÇÃO da proposta de atualização do Rol de Procedimentos e Eventos em Saúde – Nota Técnica de Recomendação Preliminar – NTRP referente às Unidades de Análises Técnicas – UATs nº 167 e 172
Foram submetidas à deliberação da Diretoria Colegiada a Nota Técnica de Recomendação Preliminares – NTRP referente as seguintes tecnologias:
- UAT nº 167 – relativa ao medicamento imunobiológico Guselkumabe, indicado proposta para tratamento de pacientes adultos com retocolite ulcerativa moderada a grave, após falha, refratariedade, recidiva ou intolerância à terapia com anti-TNFs.
- UAT nº 172 – relativa ao medicamento imunobiológico Risanquizumabe, indicado proposta para tratamento de pacientes adultos com retocolite ulcerativa moderada a grave, após falha, refratariedade, recidiva ou intolerância à terapia com anti-TNFs.
Após análises iniciais, a DIPRO traz a situação da tecnologia proposta e sua recomendação preliminar, com a respectiva motivação:




Como visto, somente a medicação Guselkumabe foi considerada, preliminarmente, apta para incorporação com o detalhamento e justificativas acima em destaques.
Considerando o resultado da análise preliminar, em especial, a recomendação desfavorável à medicação Risanquizumabe, foi proposta a abertura de Consulta Pública pelo prazo de 20 dias, no período de 09/10/2025 a 28/10/2025 para discussão dessa incorporação.
O item foi deliberado e aprovado por unanimidade, seguindo agora os próximos passos do rito de incorporação, que precederá uma nova análise final após resultados de contribuições da Consulta Pública sugerida e aprovada, com início e disponibilização dos documentos ainda nesta semana.
O M3BS faz o acompanhamento de todas as reuniões da Diretoria Colegiada da ANS para atualizar e manter o mercado informado sobre os principais pontos debatidos pela agência reguladora, além de orientar e antecipar os efeitos aplicáveis aos entes regulados frente as decisões tomadas pela agência.
Nosso time de especialistas pode atender sua necessidade! Contate-nos através do e-mail m3bsresponde@m3bs.com.br ou por telefone (11) 3115-2282.
Notícias Relacionadas
Mais Informações
MBS3 © Todos os direitos reservados.



